原标题:考前练兵:重庆实验外国语中学2022届上期中试卷
提示:
分享本文到50人以上的教师群或班级群5分钟以上,截图回复到本公众号,即可在24小时内获得word文档和答案的下载地址 ( 一般晚上发下载地址,不要反复询问,以免信息被覆盖 ) 。



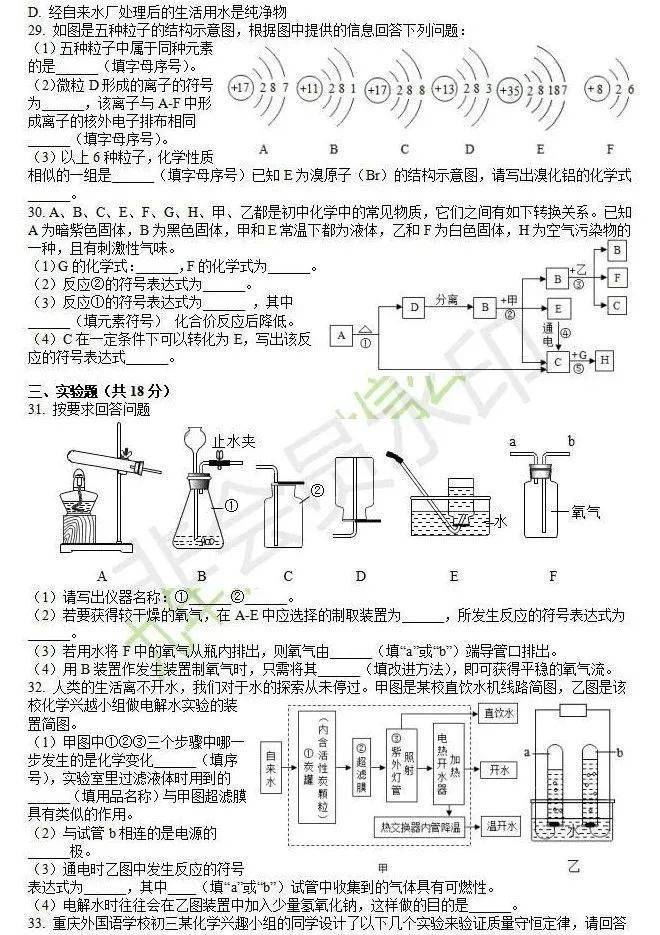
30. (1)SKCl(2)H2O2H2O+O2(3) KMnO4K2MnO4+MnO2+O2Mn(4)H2+O2H2O
【解析】A为暗紫色固体,B为黑色固体,A分解生成混合物D和C,则A为高锰酸钾,B为二氧化锰,C为氧气,D为锰酸钾与二氧化锰的混合物;甲常温下为液体,能够与B(二氧化锰)混合后得到B(二氧化锰)、E和C(氧气),则甲为过氧化氢,E为水;乙为白色固体,与B(二氧化锰)混合后得到B(二氧化锰)、F和C(氧气),则乙为氯酸钾,F为氯化钾;H为空气污染物的一种,且有刺激性气味,能够由G与C(氧气)反应生成,则H为二氧化硫,G为硫。(1)由分析可知,G为硫,其化学式为S,故填S;F为氯化钾,其化学式为KCl。(2)由分析可知,B为二氧化锰,甲为过氧化氢,则反应②是过氧化氢在二氧化锰作催化剂的条件下反应生成水和氧气。 (3)由分析可知,A为高锰酸钾,则反应①是高锰酸钾在加热的条件下反应生成锰酸钾、二氧化锰和氧气;由符号表达式可知,反应前钾元素的化合价为 +1价,锰元素的化合价为+7价,氧元素的化合价为-2价,反应后钾元素的化合价为+1价,锰酸钾中锰元素的化合价为+6价,二氧化锰中锰元素的化合价为+4价,锰酸钾、二氧化锰中氧元素的化合价为-2价,生成的氧气中氧元素的化合价为0,所以反应后元素化合价降低的元素是锰元素,其元素符号为Mn。(4)C为氧气,E为水,则C在一定条件下可以转化为E的反应是氢气与氧气在点燃的条件下反应生成水。
31. (1)锥形瓶集气瓶(2)ACKClO3KCl+O2(3)a(4)长颈漏斗换为分液漏斗
【解析】(1)由图可知,仪器①的名称是锥形瓶;仪器②的名称是集气瓶。 (2)制取干燥的氧气,可选择加热固体来生成氧气,发生装置选择固体受热发生装置,即装置A,收集氧气选择向上排空气法,即装置C;装置A的试管口处没有放棉花,则选择A装置制取氧气的反应是氯酸钾在二氧化锰作催化剂和加热的条件下反应生成氯化钾和氧气。(3)氧气不易溶于水,且氧气的密度比水小,用水将F中的氧气从瓶内排出,则水由长管,即b管进入瓶中,氧气由a管排出。(4)获得平稳的氧气流,需要控制反应的速率,通过分液漏斗的玻璃开关能够控制滴加液体的速率,进而控制反应的速率,即将装置中的长颈漏斗换为分液漏斗即可。
32.(1)③滤纸(2)正(3)H2OH2+O2b(4)增强水的导电
【解析】(1)①活性炭吸附水中的色素和异味,没有生成新物质,属于物理变化,选项错误;②超滤膜将杂质与水进行分离,没有生成新物质,属于物理变化,选项错误;③在紫外线的照射下,细菌中的物质生成新物质使细菌死亡,有新物质生成,属于化学变化,选项正确,故填③。过滤液体时用到的滤纸与甲图超滤膜具有类似的作用,能够将杂质与水进行分离。( 2)由图可知,b管中生成的气体的体积较小,是水电解后生成的氧气,氧气在连接电源正极的玻璃管中生成。(3)乙图中发生的反应是水在通电的条件下反应生成氢气与氧气。电解水时,生成的体积较大的气体为氢气,氢气具有可燃性,即b试管中收集到的气体具有可燃性。(4)电解水时往往会在乙图装置中加入少量氢氧化钠,能够增强水的导电性,加快电解水的速率。
33 (1)ABC(2)铁钉表面生成红色固体,蓝色溶液逐渐变为浅绿色(3)除去铁钉表面的铁锈(4)小于(5) Fe+O2Fe3O4调节装置内外大气压强平衡;防止装置外的空气进入瓶中改变装置的质量
【解析】(1)A.无法测量参加反应的氧气的质量,无法直接验证质量守恒定律,选项错误;B.蒸馏水与酒精混合形成溶液,属于物理变化,不能验证质量守恒定律,选项错误;C.过氧化氢反应后生成的氧气逸散到空气中,使装置的质量减少,无法直接验证质量守恒定律,选项错误;D.铁与硫酸铜反应生成硫酸亚铁和铜,反应中没有气体参加,也没有生成气体,实验前后装置的质量不变,能够直接验证质量守恒定律,选项正确;E.实验在密闭装置中进行,能够直接验证质量守恒定律,选项正确,故填ABC。(2)铁与硫酸铜反应生成硫酸亚铁和铜,实验中观察到铁钉表面生成红色固体,蓝色溶液逐渐变为浅绿色,故填铁钉表面生成红色固体,蓝色溶液逐渐变为浅绿色。(3)提前对铁钉进行打磨,除去铁钉表面的铁锈,使铁与硫酸铜充分接触,故填除去铁钉表面的铁锈。(4)镁与氧气在点燃的条件下反应生成氧化镁,根据质量守恒定律可知,参加反应的镁的质量与参加反应的氧气的质量和等于反应后生成氧化镁的质量,所以点燃前镁条质量为m1小于点燃后生成物的质量为m2,故填小于。(5)锥形瓶中发生的反应是铁与氧气在点燃的条件下生成四氧化三铁,故反应的符号表达式写为:Fe+O2Fe3O4;锥形瓶的双孔塞中插入一根一端绑有气球的玻璃管,能够防止装置外的空气进入瓶中改变装置的质量,故填调节装置内外大气压强平衡;防止装置外的空气进入瓶中改变装置的质量。
34. (1)319(2)7:8(3)5.95%(4)0.24(5)3:1(6)119.6
【解析】(1)诺氟沙星的相对分子质量是12×16+1×18+19+14×3+16×3=319;(2)若氟沙星分子中氮、氧元素的质量比=(14×3):(16×3)=7:8;(3)若氟沙星中氟元素的质量分数=;(4)由题意,一日2次,一次两粒,10日为一个疗程,患者一个疗程共服用了诺氟沙星胶囊的粒数为40粒。在这个疗程中通过若氟沙星胶囊摄入的氟元素质量=40粒× 0.1g/粒× 5.95%≈0.24g;(5)根据图示α -丙氨酸的化学式为C3H7O2N,α-丙氨酸分子中碳、氮原子的个数比为3:1;(6)设:178克α-丙氨酸中碳元素的质量与质量为x的若氟沙星中碳元素的质量相等。则有:,x=119.6g。返回搜狐,查看更多
责任编辑:


网友评论
最新评论